| » Статистика |
Онлайн всего: 1 Гостей: 1 Пользователей: 0 |
|
билет 10
|
| 16.02.2010, 17:28 |
Билет № 10
1. Реакции ионного обмена. Условия их протекания до конца. Отличие реакций ионного обмена от окислительно-восстановительных.
1. ПЛАН ОТВЕТА
1. Реакции ионного обмена.
2. Условия протекания реакций ионного обмена до конца.
3. Отличие реакций ионного обмена от окислительно-вос¬становительных .
Ответ можно начать с положения о том, что по¬скольку электролиты в растворах образуют ионы, то реакции в них происходят не между молекулами, а между ионами.
Если смешать растворы двух диссоциирующих веществ, то положительно заряженные ионы (кати¬оны) взаимодействуют с ионами, заряженными от¬рицательно (анионами).
Это положение следует подтвердить примерами.
1. Одно из образующихся веществ является малодиссоциирующим. Это может быть:
а) осадок АgNОз + NаС1 = NaNO3 + АgСl↓
Ag+ + NO3- +Na+ + Cl- = Na+ + NO3- + АgСl↓
Ag+ + Cl- = АgСl↓
CO2↑
б) газ Na2CO3 + 2 HCl = 2NaCl + H2CO3
H2O
В результате реакции образуется угольная кислота, которая разлагается на газ оксид углерода(IV) и воду.
2Na+ +CO32- + 2H+ +2 Cl-= 2Na++2 Cl- +CO2↑+ H2O
CO32- + 2H+ = CO2↑+ H2O
в) вода
НС1 + NaОН = NaС1 + Н2O
Н+ + Сl- + Nа+ + ОН- = Na+ + Сl- + Н2O
Н+ + ОН- = Н2O(реакция нейтрализации)
2. Образующиеся вещества — сильные электро¬литы. Они хорошо растворимы в воде и полностью диссоциируют на ионы:
ВаС12 + 2NaОН = Ва(ОН)2 + 2NаС1
Ва2+ + 2Сl- + 2Nа+ + 2OН- = Ва2+ + 2OН- +2Nа+ +2Сl-
Все участвующие в реакции вещества находятся в виде ионов. Связывание их с образованием нового вещества не происходит, поэтому реакция в этом случае практически не осуществима.
Приведенные примеры свидетельствуют о том, что необходимыми условиями протекания реакций ионного обмена до конца являются: 1) образование осадка;
2) выделение газа;
3) образование малодиссоциирующих молекул воды.
Естественно, что в ходе ответа можно приводить другие примеры реакций ионного обмена, но при этом важно помнить об использовании таблицы «Растворимость кислот, оснований и солей в воде», из которой видно, какое вещество растворимо, а какое — нет.
Отличительной особенностью реакции ионного обмена от окислительно-восстановительных реакций является то, что они протекают без изменения степе¬ней окисления, участвующих в реакции частиц.
2. Опыт. Получение и собирание водорода. Доказательство наличия этого газа в пробирке
В лаборатории водород можно получить действи¬ем раствора кислоты (кроме азотной) на металлы.
Например, действием хлороводородной кислоты (НС1) на цинк (в ряду напряжений металл должен находить¬ся левее водорода):
Zn + 2НС1 = ZnС12 + Н2↑
Собрать водород можно вытеснением воды (а) или вытеснением воздуха (б).
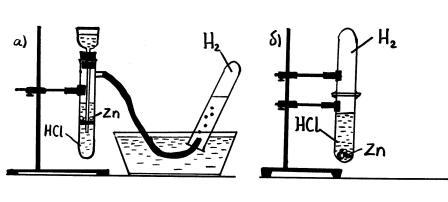
Далее необходимо доказать наличие водорода в пробирке. Для этого после наполнения пробирки во¬дородом ее аккуратно снимают, поворачивают вверх отверстием, одновременно поднося к нему горящую спичку (лучину).
Сгорание чистого водорода сопровождается сла¬бым хлопком: 2Н2 + O2 = 2Н2О + Q и запотеванием стенок пробирки (на холодных стенках оседают ка¬пельки воды).
|
|
Категория: Экзаменационные билеты | Добавил: chimik
|
| Просмотров: 4580 | Загрузок: 0
| Рейтинг: 3.4/7 |
|
|
|